类器官研究最新进展(2022年11月)
1.Cell:通过肝脏类器官揭示与GCKR-rs1260326突变有关的NAFLD/NASH风险非常高
doi:10.1016/j.cell.2022.09.031
众所周知,背景会影响许多领域。如今,在一项新的研究中,来自日本东京医科大学和美国辛辛那提儿童医院医疗中心的研究人员发现,患者的健康背景(health context)---患者的其他疾病--可以决定特定的基因突变是有益还是有害。他们揭示一种与肝脏疾病有争议关系的基因突变,根据患者是否患有糖尿病,给患者带来不同程度的风险。相关研究结果发表在2022年10月27日的Cell期刊上,论文标题为“En masse organoid phenotyping informs metabolic-associated genetic susceptibility to NASH”。
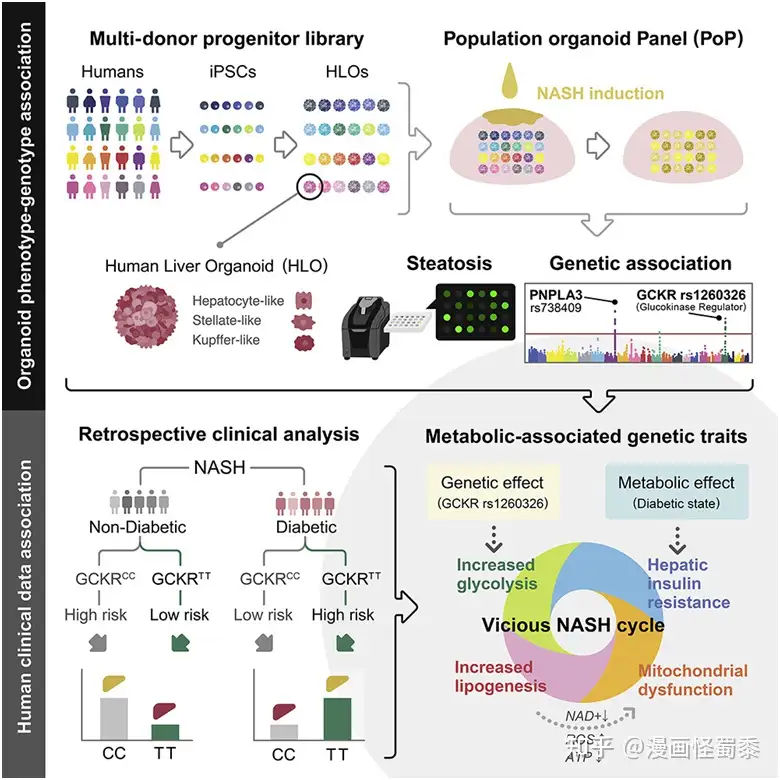
图片来自Cell, 2022, doi:10.1016/j.cell.2022.09.031。
非酒精性脂肪肝(non-alcoholic fatty liver disease, NAFLD)是最常见的肝脏疾病,并可发展为涉及肝脏中脂肪堆积、损害和炎症的非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)。已知的遗传变异仅解释了患有NAFLD/NASH风险的一小部分,而且科学家们对某些突变的重要性有不同意见。
论文第一作者、辛辛那提儿童医院医疗中心的Masaki Kimura说,“葡萄糖激酶调节蛋白(GCKR)-rs1260326突变与NAFLD的关系存在广泛争议。这种突变似乎可以保护患者免受糖尿病和慢性肾脏疾病的影响,但与NAFLD和其他疾病的风险增加有关。”
2.Nature:将人类皮层类器官移植到大鼠大脑中来研究大脑连接性和功能性
doi:10.1038/s41586-022-05277-w
在一项新的研究中,来自美国斯坦福大学的研究人员开发出一种研究方法,可以更详细地探究与一些神经疾病和精神疾病相关的大脑过程。这是通过在体外培养人类皮层类器官(cortical organoids)并将它们移植到发育中的啮齿动物大脑内以观察它们随着时间的推移如何整合和发挥功能来实现的。相关研究结果发表在2022年10月13日的Nature期刊上,论文标题为“Maturation and circuit integration of transplanted human cortical organoids”。
美国国立精神卫生研究所(NIMH)的David Panchision博士说,“这项新的研究代表着科学家们在研究复杂的人类大脑疾病的细胞和回路基础的能力方面取得了重大进展。它允许类器官在一种更具有生物相关性的环境中建立连接,并以它们在培养皿中无法做到的方式发挥作用。”
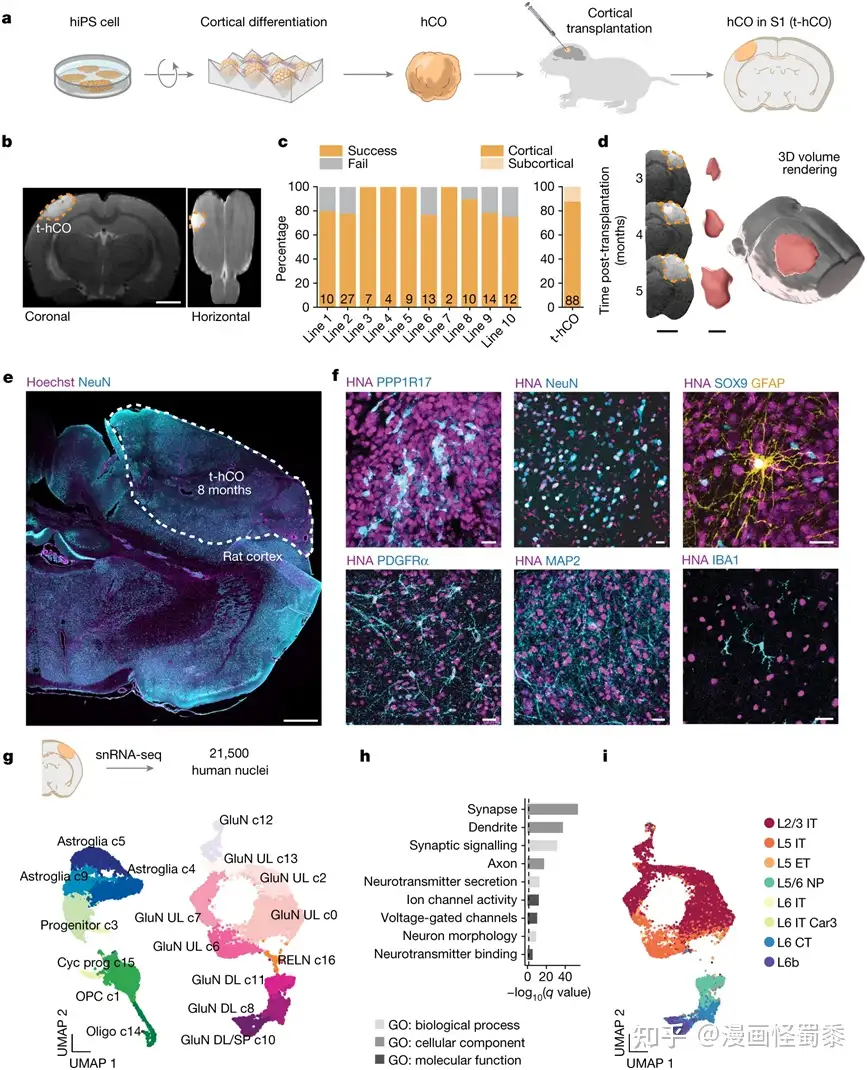
人类皮层类器官移植在发育中的大鼠皮层内。图片来自Nature, 2022, doi:10.1038/s41586-022-05277-w。
在这项新的研究中,这些作者通过将完整的利用人类干细胞培养出的人类皮层类器官移植到发育中的大鼠大脑内,推进了大脑类器官的研究使用。这项技术构建了一个可以被检查和操纵的人类组织单元。他们使用Pasca实验室之前开创的方法:利用人类诱导性多能干细胞---成体皮肤细胞经过重编程后进入一种未成熟的类似干细胞的状态---构建出人类皮层类器官。他们随后将所构建的人类皮层类器官植入大鼠初级体感皮层,即大脑中参与处理感觉的一部分。
为了了解人类皮层类器官能在多大程度上整合到大鼠的初级体感皮层,这些作者用一种作为功能性连接的一种指示剂可在脑细胞中传播的示踪性病毒感染了皮层类器官。在将携带示踪性病毒的人类皮层类器官移植到大鼠的初级体感皮层后,他们在诸如腹基核(ventrobasal nucleus)和体感皮层之类的多个大脑区域检测到了这种病毒。此外,他们还观察到丘脑和移植区域之间建立了新连接。这些连接可通过电刺激和刺激大鼠的胡须激活,表明它们正在接受有意义的感觉输入。此外,他们能够激活移植的人类皮层类器官中的人类神经元,以调节大鼠的奖励寻求行为。这些发现表明,移植的人类皮层类器官与大鼠中特定的大脑通路进行了功能整合。
在结构和功能上,经过七到八个月的生长后,移植的人类皮层类器官比在体外细胞培养中维持的人类皮层类器官更类似于人类大脑组织的神经元。移植的人类皮层类器官反映了人类皮层神经元的结构和功能特征,这一事实使得这些作者想知道他们是否可以使用移植的人类皮层类器官来探究人类疾病过程的各个方面。
3.Nature:利用人类大脑类器官绘制人类大脑发育图谱
doi:10.1038/s41586-022-05279-8
在一项新的研究中,瑞士苏黎世联邦理工学院生物系统科学与工程系的Barbara Treutlein教授和她的同事们如今在不同的时间点和非常详细地研究了人类大脑类器官内的数千个细胞。他们的目标是用分子遗传学术语来描述这些细胞:换句话说,所有基因转录本(转录组)的总量作为基因表达的衡量标准,同时基因组可访问性作为调节活性的衡量标准。他们成功地将这些数据表示为一种图谱,用于显示这种大脑类器官内每个细胞的分子指纹。相关研究结果于2022年10月5日在线发表在Nature期刊上,论文标题为“Inferring and perturbing cell fate regulomes in human brain organoids”。
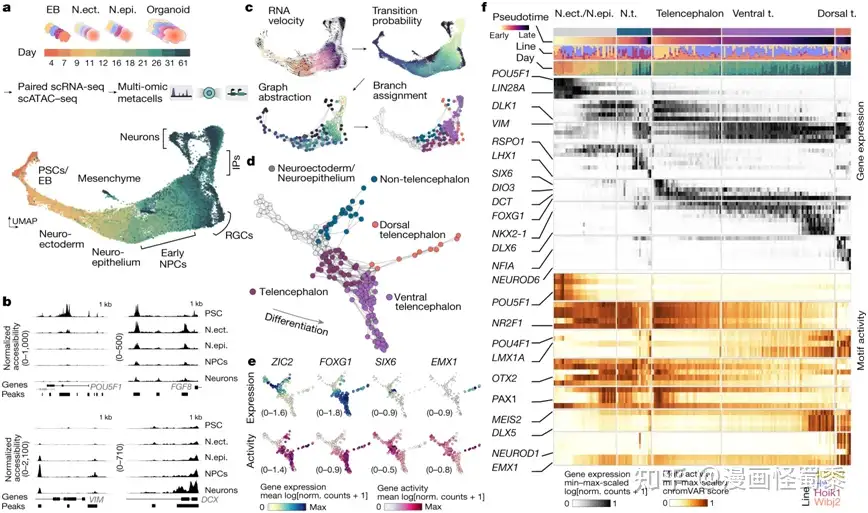
大脑类器官发育的多组学图谱揭示了发育的层次和命运决定的关键阶段。图片来自Nature, 2022, doi:10.1038/s41586-022-05279-8。
这项新研究的目的是系统地确定那些对大脑器官不同区域的神经元发育有重大影响的基因开关。在CRISPR-Cas9系统的帮助下,这些作者有选择地关闭了每个细胞中的一个基因,在整个大脑类器官中同时关闭了大约二十多个基因。这使他们能够发现各自的基因在大脑类器官的发育中发挥了什么作用。
论文共同第一作者、Treutlein团队博士生Sophie Jansen解释说,“这项技术可用于筛选参与疾病的基因。此外,我们还可以看看这些基因对大脑类器官内不同细胞的发育所产生的影响。”
4.Cell:利用人类大脑类器官成功再现人类大脑发育中的关键事件
doi:10.1016/j.cell.2022.09.010
类器官(organoid)是在培养皿中精心培养的细胞集合,旨在比传统的细胞培养物更好地模拟器官结构和组成,使得人们对大脑等器官的生长和发育有了独特的看法。为了使它们在实验中发挥作用,科学家们需要确定这些模型如何忠实地再现体内细胞的行为。
如今,在一项新的研究中,来自美国布罗德研究所的研究人员发现人类大脑类器官重现了正在发育的负责运动、感知和思考的人类大脑皮层中的许多重要细胞和分子事件。相关研究结果发表在2022年9月29日的Cell期刊上,论文标题为“Proper acquisition of cell class identity in organoids allows definition of fate specification programs of the human cerebral cortex”。
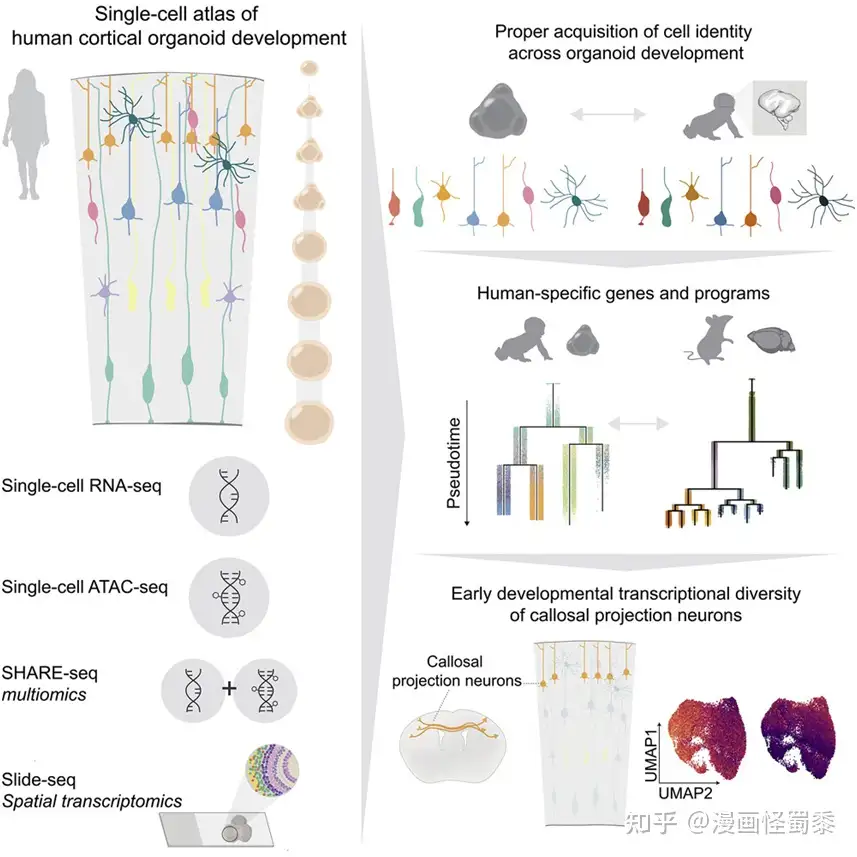
图片来自Cell, 2022, doi:10.1016/j.cell.2022.09.010。
这些作者利用干细胞培育出了大脑类器官,并在六个月的时间里仔细研究了它们的生长情况,为此他们使用了在单细胞水平上随着时间的推移绘制细胞位置、基因表达和染色质可及性---决定了基因活性如何受到调节---的工具。他们随后构建了一个“图谱”,描述了从大脑类器官中提取的60多万个在发育和成熟过程中被采样的细胞。他们发现,第一个月后,在他们制作的每个大脑类器官中,相同类型的细胞以相同的顺序发育,并表达了与发育中的人类胚胎相同的基因。
论文通讯作者、布罗德研究所斯坦利精神病研究中心副成员的Paola Arlotta说,“这对我们来说证实这一点是非常重要的。这告诉我们,我们可以用这些人类大脑类器官来研究我们之前无法研究的人脑发育过程。”
这些作者还能够确定人类特有的基因表达模式和其他关键发育因子。他们建议,由于这些大脑类器官是相当准确的早期大脑发育模型,并且可以在实验室中利用一小部分干细胞相对大量地培育出,这些模型可能能够有助于加快对大脑健康和神经发育障碍的研究。
5.Cell Stem Cell:新研究优化人类小肠类器官的产生
doi:10.1016/j.stem.2022.08.002
在一项新的研究中,来自荷兰皇家艺术与科学学院和玛西玛公主儿科肿瘤中心的研究人员改进了人类小肠类器官(small intestinal organoids)---小肠的微型版本---的培育。这将帮助人们更好地研究小肠在健康和疾病期间的功能。具体来说,他们成功地开发出了包含成熟的潘氏细胞(Paneth cell)的小肠类器官,而潘氏细胞在以前的人类小肠类器官中是不存在的。相关研究结果于2022年8月23日在线发表在Cell Stem Cell期刊上,论文标题为“Optimized human intestinal organoid model reveals interleukin-22-dependency of paneth cell formation”。
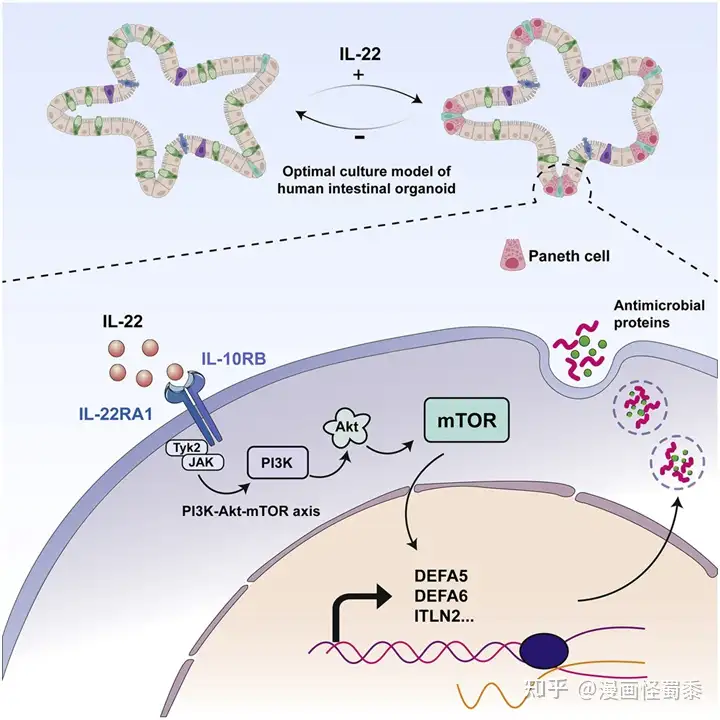
图片来自Cell Stem Cell, 2022, doi:10.1016/j.stem.2022.08.002。
为了诱导人类小肠类器官中潘氏细胞的形成,这些作者研究了多种分子的影响。他们发现,白细胞介素-22(IL-22)增加了潘氏细胞的数量和活性。IL-22对潘氏细胞的影响是令人惊讶的。论文共同第一作者、荷兰皇家艺术与科学学院研究员Gui-Wei He解释了其中的原因:“目前,人们认为IL-22能促进干细胞功能。我们的研究实际上表明,IL-22并没有这样做,而是刺激了潘氏细胞的激活。”因此,这种新发现的IL-22功能被用来增加人类小肠类器官中活跃的潘氏细胞的数量。这导致了模拟健康小肠的类器官的构建。
6.Science子刊:利用人类肾脏类器官确定化合物SCR7有望阻止肾脏损伤和治疗慢性肾脏病
doi:10.1126/scitranslmed.abj4772
在某种程度上,肾脏在受伤后有自我修复的能力,但是这种内在修复会转变为不完全修复,从而导致不可逆的损伤和慢性肾脏病(CKD)。在一项新的研究中,来自麻省总医院(MGH)研究人员利用人类干细胞衍生的肾脏类器官鉴定出对维持肾脏健康修至关重要的基因。这些发现可能会导致人们发现新的靶标,以协助预防或治疗CKD。相关研究结果发表在Science Translational Medicine期刊上,论文标题为“Modeling injury and repair in kidney organoids reveals that homologous recombination governs tubular intrinsic repair”。
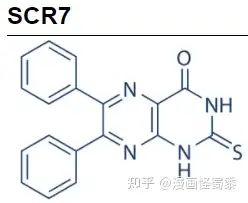
SCR7化学结构式。
论文共同第一作者、MGH肾脏科研究员Navin Gupta博士和他的同事们将人类肾脏类器官暴露于化疗药物顺铂中时,这种治疗改变了正在进行内在修复的肾细胞中的159个基因表达和29条信号通路。他们确定的许多基因,包括两个名为FANCD2和Rad51的基因,在内在修复过程中被激活,但是当肾脏损伤变得不可逆时,它们的表达就会下降。这些基因编码的蛋白在细胞中的DNA受损时发挥着修复作用。在小鼠肾脏损伤模型和人类肾脏活组织中进行的其他实验证实了这些在肾脏类器官中发现的结果。
最后,通过药物筛选试验,这些作者确定了一种称为SCR7的化合物,它有助于维持FANCD2和RAD51的活性,以拯救正常的组织修复,并防止在顺铂诱导的肾脏类器官损伤模型中出现CKD进展。
SCR7 是一种特异性 DNA Ligase IV 抑制剂,可阻断非同源性末端连接(NHEJ)。在哺乳动物细胞和小鼠胚胎中,SCR7可增加利用CRISPR/Cas9进行HDR(homology directed repair, 同源介导的双链DNA修复)介导的基因编辑效率,最高可增强至19倍。
7.Nat Cancer:利用功能性类器官筛选鉴定出靶向实体瘤中癌干细胞的抗体MCLA-158
doi:10.1038/s43018-022-00359-0
在一项新的研究中,由西班牙巴塞罗那生物医学研究院主任Eduard Batlle博士领导的一个国际研究小组揭示了导致MCLA-158发现的临床前数据及其对癌干细胞的作用机制。这种被命名为派森妥单抗 (Petosemtamab)的抗体MCLA-158能防止癌症转移的发生(即癌症扩散到其他重要器官),并减缓癌症实验模型中原发性肿瘤的生长。相关研究结果发表在2022年4月的Nature Cancer期刊上,论文标题为“Functional patient-derived organoid screenings identify MCLA-158 as a therapeutic EGFR × LGR5 bispecific antibody with efficacy in epithelial tumors”。在这篇论文中,他们描述了他们如何创建他们的纳米胶囊,以及当在患有胶质母细胞瘤的小鼠身上进行测试时它的效果如何。
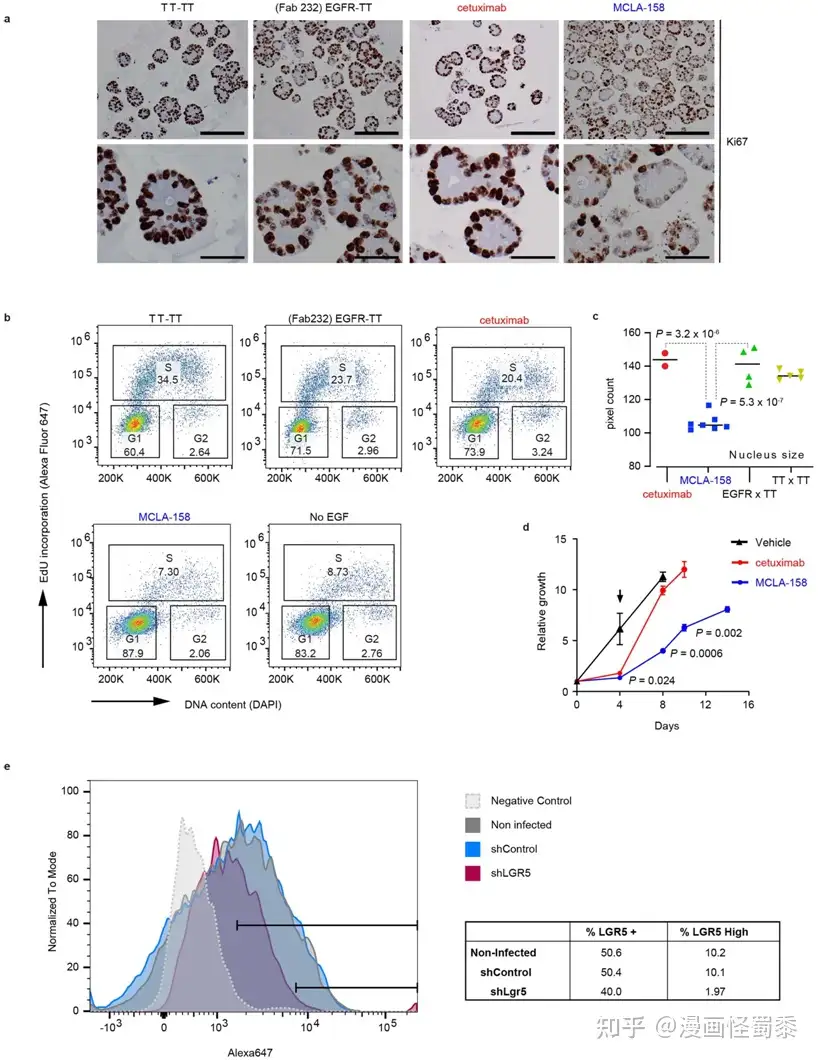
MCLA-158对患者衍生性类器官的影响。图片来自Nature Cancer, 2022, doi:10.1038/s43018-022-00359-0。
这项研究也为制药公司在药物发现过程中使用类器官模型奠定了基础。类器官是可以在实验室中生长的患者衍生性样本,它们再现了肿瘤区室的某些方面。到目前为止,它们的用处正在个性化癌症医学中得到探索---意思是它们在帮助医生决定每名患者的最佳治疗方面的价值。然而,为了选择MCLA-158,首次使用了来自癌症患者的类器官生物库,在数百种新抗体中分辨出哪一种最有效并最适合大多数患者。
2021年10月,荷兰Merus公司(Merus N. V.)报告了与中期疗效分析相对应的初步数据,这些数据是基于它赞助的正在进行的1期剂量扩大临床试验的回顾性分析,该临床试验旨在评估MCLA-158单药治疗晚期头颈部鳞状细胞癌(HNSCC)的安全性、耐受性和抗肿瘤活性。7名HNSCC患者中有3人获得部分反应,其中1人在2021年8月的数据截止日期后获得完全反应。所有七名患者都观察到肿瘤缩小。
8.Nat Commun:新研究表明恢复TCF4基因功能的基因疗法有望治疗皮特-霍普金斯综合征
doi:10.1038/s41467-022-29942-w
在一项新的研究中,来自加州大学圣地亚哥分校医学院的研究人员人类大脑类器官揭示了一个基因发生的与一种严重的自闭症形式相关的突变如何破坏神经发育。利用基因治疗工具恢复这个基因的功能,有效地拯救了神经结构和功能。相关研究结果于2022年5月2日发表在Nature Communications期刊上,论文通讯作者为“Transcription Factor 4 loss-of-function is associated with deficits in progenitor proliferation and cortical neuron content”。
这个称为TCF4的基因是大脑发育的一个重要基因。包括自闭症谱系障碍(ASD)和精神分裂症内的一些神经和神经精神疾病都与TCF4基因突变有关。转录因子调节其他基因的开启或关闭,因此它们的存在或缺乏都会对发育中的胚胎产生多米诺效应。然而,当TCF4发生突变时,人们对人脑发生的情况知之甚少。
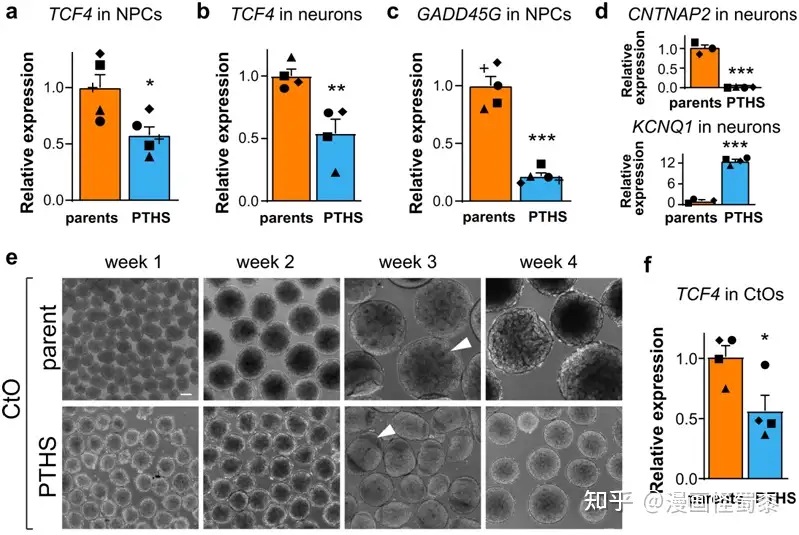
PTHS类器官显示异常发育。图片来自Nature Communications, 2022, doi:10.1038/s41467-022-29942-w。
为了探索这个问题,这些作者着重关注皮特-霍普金斯综合征(Pitt-Hopkins Syndrome, PTHS)上,这是一种由TCF4突变引起的特殊ASD。患有这种遗传病的儿童有严重的认知和运动障碍,而且通常是不说话的。
现有的皮特-霍普金斯综合征小鼠模型无法准确模拟患者的神经特征,因此这些作者转而构建出这种疾病的人类研究模型。他们利用干细胞技术,将患者的皮肤细胞转化为诱导性多能干细胞(iPSC),然后利用iPSC培育出三维大脑类器官,也称为“迷你大脑(mini-brain)”。对这些大脑类器官的初步观察显示,存在TCF4突变的大脑类器官与对照组之间存在一系列的结构和功能差异。
9.Cell:新研究揭示了为何威廉姆斯-伯伦综合征患者通常具有优异的听觉能力
doi:10.1016/j.cell.2022.08.022
威廉姆斯-伯伦综合征(Williams-Beuren syndrome, WBS)是一种罕见的疾病,会导致神经认知和发育方面的缺陷。然而,音乐和听觉能力在WBS患者身上得到了保留,甚至增强。在一项新的研究中,来自美国圣犹大儿童研究医院的研究人员在这种疾病的模型中发现了这种能力的机制。相关研究结果于2022年9月23日在线发表在Cell期刊上,论文标题为“Innate frequency-discrimination hyperacuity in Williams-Beuren syndrome mice”。
论文通讯作者、圣犹大儿童研究医院发育神经生物学系的Stanislav Zakharenko博士说,“WBS之所以在神经发育障碍中更为人所关注,是因为患有这种疾病的儿童,尽管有严重的学习障碍,但与普通人群中的儿童相比,他们中有更多的人具有优越的音乐和语言能力。我们对此很感兴趣,想知道更多关于一种由27个基因缺失引起的疾病如何可能帮助患者获得比正常人更好的听觉处理能力。”
为了了解WBS患者听觉能力增强的细胞生物学基础,这些作者进行了RNA测序(RNAseq)实验。这些数据使得他们发现了一种叫做VIPR1的神经肽受体,它在WBS患者的听觉皮层中的表达减少了。在大脑类器官中也发现了VIPR1的减少,其中大脑类器官是实验室中使用人类诱导性多能干细胞构建出的高级模型。
这些作者发现,转录因子Gtf2ird1(由WBS患者丢失的27个基因之一编码)调节着VIPR1。在听觉皮层中剔除或过度表达VIPR1可以模拟或逆转WBS中观察到的听觉效果。因此,正是Gtf2ird1下调了VIPR1,导致了WBS对听觉能力的影响。
10.Science:新研究发现现代人类比尼安德特人产生更多的大脑神经元
doi:10.1126/science.abl6422
长期以来,是什么使现代人变得独特的问题一直是科学家们的推动力。因此,与我们的近亲尼安德特人(Neandertals)的比较提供了迷人的见解。大脑尺寸的增加,以及大脑发育过程中神经元的产生,被认为是人类进化过程中出现的认知能力提高的主要因素。然而,虽然尼安德特人和现代人的大脑大小相似,但对于现代人和尼安德特人的大脑在发育过程中是否可能在神经元的产生方面有所不同,人们所知甚少。
在一项新的研究中,来自德国马克斯-普朗克分子细胞生物学与遗传学研究所(MPI-CBG)等研究机构的研究人员如今发现,现代人的TKTL1(transketolase-like 1)蛋白变体与尼安德特人的TKTL1变体仅有一个氨基酸的差异,使得在现代人的大脑中增加了一种称为基底放射状胶质细胞(basal radial glia)的脑祖细胞。基底放射状胶质细胞在发育中的新皮层中产生大部分的神经元,而新皮层是大脑的一部分,对许多认知能力至关重要。由于TKTL1在胎儿人脑额叶中的活性特别高,他们得出结论,TKTL1中这种人类特有的单个氨基酸替换导致现代人比尼安德特人在发育中的新皮层额叶中产生更多神经元。相关研究结果发表在2022年9月9日的Science期刊上,论文标题为“Human TKTL1 implies greater neurogenesis in frontal neocortex of modern humans than Neanderthals”。
这些作者专注于其中的一种称为TKTL1的蛋白:与尼安德特人相比,基本上所有的现代人在这种蛋白上都出现了一个氨基酸变化。具体来说,在现代人中,TKTL1在有关的序列位位点上含有一个精氨酸,而在尼安德特人的TKTL1中,这个位点是一个称为赖氨酸的氨基酸。在胎儿的人类新皮层中,TKTL1在新皮层祖细胞中发现,所有皮层神经元都是从这些新皮层祖细胞中产生的。值得注意的是,TKTL1的水平在额叶的新皮层祖细胞中是最高的。
此后,这些作者探讨了这些影响与人类大脑发育的相关性。为此,他们在人类大脑类器官---可以在实验室的细胞培养皿中由人类干细胞培养出来的微型器官样结构,可模拟人类早期大脑发育的各个方面---中用尼安德特人TKTL1特有的赖氨酸取代了现代人TKTL1中的精氨酸。
Pinson说,“我们发现,在TKTL1中使用尼安德特人特有的赖氨酸时,产生的基底放射状胶质细胞比使用现代人特有的精氨酸要少,因此,产生的神经元也更少。这向我们表明,尽管我们不知道尼安德特人的大脑有多少神经元,但我们可以假设现代人在大脑额叶有比尼安德特人更多的神经元,而TKTL1的活性在大脑额叶中是最高的。”
这些作者还发现,现代人类的TKTL1通过改变代谢发挥作用,特别是刺激磷酸戊糖途径,然后增加脂肪酸的合成。通过这种方式,现代人类的TKTL1被认为增加了某些膜脂质的合成,这些膜脂质是产生基底放射状胶质细胞的长突起所必需的,所产生的长长突起刺激基底放射状胶质细胞的增殖,因此,增加了神经元的产生。
文章原文作者:知乎用户“漫画怪蜀黍”,文章来源https://zhuanlan.zhihu.com/p/588076218



