重磅:国内首部《细胞和基因治疗产品快速无菌检查法的验证技术要求》7月28日起实施
2022年6月28日,全国团体信息平台发布了由上海市食品药品检验研究院、上海药监局上海药品审评核查中心和上海医药行业协会等共同起草的《细胞和基因治疗产品快速无菌检查法的验证技术要求》(T/SHPPA 012—2022)团体标准,2022年07月28日起实施,此《细胞和基因治疗产品快速无菌检查法的验证技术要求》团体标准遵循《药品生产质量管理规范(2010年修订)》有关要求,本文件规定了采用基于微生物生长原理的培养系统,对细胞和基因治疗产品进行快速无菌检查法的验证技术要求,弥补了国内细胞和基因治疗产品快速无菌检查法的验证技术领域的空白。

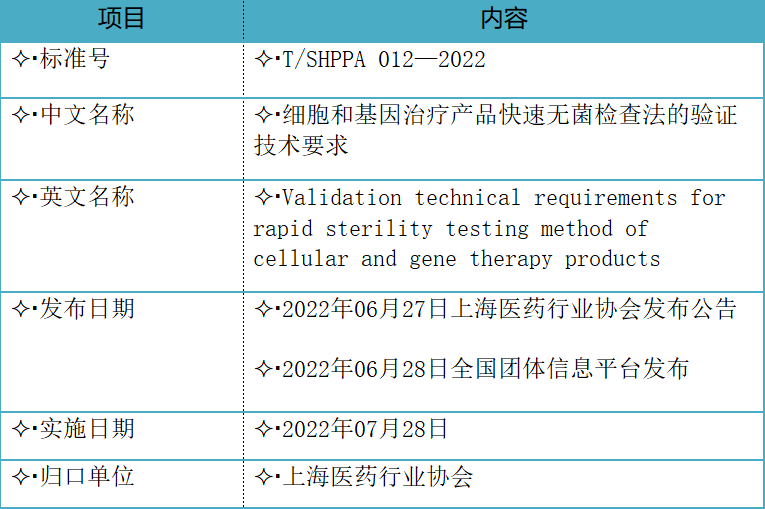
一、《细胞和基因治疗产品快速无菌检查法的验证技术要求》标准信息
二、《细胞和基因治疗产品快速无菌检查法的验证技术要求》起草单位、起草人和执行单位

三、细胞和基因治疗产品快速无菌检查方法创新的必要性
近年来,国内细胞和基因治疗产品迎来快速发展阶段,逐渐从分子治疗时代逐渐迈入细胞治疗时代,因其在肿瘤领域临床研究中取得的显著疗效而成为国内外研究的热点。但该类制品在存在诸多特殊性,如细胞和基因治疗产品有别于传统的无菌药品,存在工艺差异性大、产量少、效期短、临床需求紧迫等特殊性,现有的药典无菌检查法难以适用,故需要对产品进行快速检测,如无菌检查试验仍然按现行版2020年版《中国药典》中的无菌试验方法检查,这将不利于这类产品的研发和最终产品的无菌保证,2021年10月26日,国家药典委员会官网发布《细胞类制品微生物检查法》征求意见稿,公示期为三个月,弥补了国内细胞和基因治疗产品快速微生物替代方法领域的空白;2022年6月28日,《细胞和基因治疗产品快速无菌检查法的验证技术要求》(T/SHPPA 012—2022)的落地实施,弥补了国内细胞和基因治疗产品对快速无菌检查法的验证要求。
(1)取样和检验量要求
应从产品中取样,对于产品量较少,可选择代表性、关键性的样品,混批样品或替代样品等进行方法验证。验证时,每份培养基的产品接种量与产品放行快速无菌检查保持一致。对于单个容器且总体积(V)在1mL~1L的单一批次细胞产品,接入每种培养基的最少量不应低于表1。对于总量小于1mL的单一批次产品,可经评估后采用替代取样方案、过程检查或其他适宜方式。

(2)验证参数
本标准对快速无菌检查法的验证要求做了规定,应至少包括:专属性、检测限、重现性、耐用性。

(3)其他要求
本标准对与药典方法的平行实施期、方法的再确认或再验证也提出了要求。
1)与药典方法的平行实施期
✔采用快速无菌检查法作为放行方法前,应先通过专属性、检测限、重现性及耐用性等参数的试验,完成与药典方法的比较,选择至少3批拟采用该方法的样品进行方法适用性试验,确认试验结果能够完全满足快速无菌检查法的要求后,可以接纳该方法进入平行实施期。
✔快速无菌检查法在完成替代方法学验证后,可采用该方法进行产品检验,并同步实施药典方法检测,累计一定数量批次数据,以评估无菌快速检查法和药典无菌检查方法的一致性。
✔平行实施期应以药典方法的检验结果为产品无菌检查的最终判定依据。
✔药典方法和快速无菌检查法检验结果不一致时,应对检验过程予以充分的调查,分析造成无菌检查结果不一致的原因。收集、纯化检验过程中发现的污染微生物,并建立污染微生物菌种库。
2)方法的再确认或再验证
应持续关注生产、检验过程中可能对方法适用性造成的影响,依据评估结果,判断变更是否影响方法适用性,对方法进行全面或部分再确认或再验证,包括但不限于:
✔——生产工艺变更导致产品组分或浓度改变;
✔——检验方法参数变化影响污染微生物活力;
✔——检验样品中是否含有抑菌物质。
近年来,随着一些创新药物的出现,法定的无菌检查经典方法已不能很好地适应新形势新情况,《细胞和基因治疗产品快速无菌检查法的验证技术要求》2022年07月28日起实施,对细胞和基因治疗产品进行快速无菌检查法的验证技术要求,适用于效期短、批量小,采用现行药典方法无法保证在产品使用前完成放行检查的细胞和基因治疗产品,亦可作为细胞和基因治疗产品临床试验阶段采用快速无菌检查法的执行参考依据,对快速无菌检查法的验证要求做了规定,应至少包括:专属性、检测限、重现性、耐用性,随着创新药品上市,这些快速替代方法将会得到广泛应用。



